√Energi Dalam Gas Ideal ⊗ Full Pembahasanya
Energi Dalam gas ideal
Energi dalam gas ideal monoatomik
Energi dalam gas ideal monoatomik merupakan jumlah total energi kinetik translasi molekul‐molekul gas ideal monoatomik. Jumlah total energi kinetik translasi molekul‐molekul gas ideal = hasil kali antara energi kinetik translasi rata‐rata setiap molekul dengan jumlah molekul (N). Secara matematis :

Keterangan :
U = Energi dalam gas ideal monoatomik (J)
N = Jumlah molekul
k = Konstanta Boltzmann (k = 1,38 x 10 ‐23 J/K)
T = Suhu mutlak (K)
n = Jumlah mol (mol)
R = Konstanta gas universal (R = 8,315 J/mol.K = 8315 kJ/kmol.K)
Energi dalam gas ideal diatomik
Energi dalam gas ideal diatomik merupakan jumlah total energi kinetik translasi, energi kinetik rotasi dan energi kinetik vibrasi molekul‐molekul gas ideal diatomik. Sesuai dengan prinsip ekipartisi energi, energi dalam gas ideal diatomik adalah :
U = 5/2 n R T
Energi dalam gas ideal poliatomik
Energi dalam gas ideal poliatomik merupakan jumlah total energi kinetik translasi, energi kinetik rotasi dan energi kinetik vibrasi molekul‐molekul gas ideal poliatomik. Sesuai dengan prinsip ekipartisi energi, energi dalam gas ideal poliatomik adalah :
U = 7/2 n R T
Energi dalam gas ril
Energi dalam gas ril bergantung juga pada suhu alias temperatur. Ketika tekanan gas ril cukup besar (volume gas ril kecil), gas ril mulai menunjukkan perilaku menyimpang. Karenanya, bisa dikatakan bahwa energi dalam gas ril bergantung juga pada tekanan dan volume.
Energi Dalam gas ideal
Energi dalam gas ideal monoatomik
Energi dalam gas ideal monoatomik merupakan jumlah total energi kinetik translasi molekul‐molekul gas ideal monoatomik. Jumlah total energi kinetik translasi molekul‐molekul gas ideal = hasil kali antara energi kinetik translasi rata‐rata setiap molekul dengan jumlah molekul (N). Secara matematis :

Keterangan :
U = Energi dalam gas ideal monoatomik (J)
N = Jumlah molekul
k = Konstanta Boltzmann (k = 1,38 x 10 ‐23 J/K)
T = Suhu mutlak (K)
n = Jumlah mol (mol)
R = Konstanta gas universal (R = 8,315 J/mol.K = 8315 kJ/kmol.K)
Energi dalam gas ideal diatomik
Energi dalam gas ideal diatomik merupakan jumlah total energi kinetik translasi, energi kinetik rotasi dan energi kinetik vibrasi molekul‐molekul gas ideal diatomik. Sesuai dengan prinsip ekipartisi energi, energi dalam gas ideal diatomik adalah :
U = 5/2 n R T
Energi dalam gas ideal poliatomik
Energi dalam gas ideal poliatomik merupakan jumlah total energi kinetik translasi, energi kinetik rotasi dan energi kinetik vibrasi molekul‐molekul gas ideal poliatomik. Sesuai dengan prinsip ekipartisi energi, energi dalam gas ideal poliatomik adalah :
U = 7/2 n R T
Energi dalam gas ril
Energi dalam gas ril bergantung juga pada suhu alias temperatur. Ketika tekanan gas ril cukup besar (volume gas ril kecil), gas ril mulai menunjukkan perilaku menyimpang. Karenanya, bisa dikatakan bahwa energi dalam gas ril bergantung juga pada tekanan dan volume.
Energi kinetik rata-rata gas
Selain tekanan, salah satu besaran yang menyatakan sifat makroskopis gas adalah suhu (T). Persamaan Tekanan gas yang telah diturunkan pada topik Teori Kinetik Gas ditulis lagi :



Persamaan Hukum Gas Ideal yang telah diturunkan pada topik Hukum Gas Ideal ditulis lagi :
PV = NkT → Persamaan b
Perhatikan persamaan a dan persamaan b. Ruas kiri sama, sedangkan ruas kanan hampir sama. Karena ruas kiri sama, maka kedua persamaan tersebut bisa digabungkan :

Jika kita kalikan ruas kiri dan ruas kanan dengan 3/2 maka persamaan ini akan berubah bentuk menjadi :


Suhu berbanding lurus dengan Energi kinetik translasi rata‐rata dari molekul‐molekul gas. Semakin besar suhu, semakin besar energi kinetik translasi rata‐rata, sebaliknya semakin kecil suhu, semakin kecil energi kinetik translasi rata‐rata. Kita bisa menyimpulkan bahwa suhu merupakan ukuran dari energi kinetik translasi rata‐rata molekul.
Persamaan suhu mutlak vs energi kinetik translasi 2 bisa ditulis ke dalam bentuk yang berbeda :



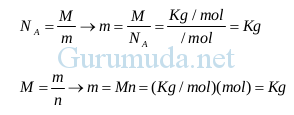
Pertama, energi kinetik translasi merupakan energi kinetik yang dimiliki oleh benda atau molekul yang melakukan gerak translasi. Gerak translasi dapat berupa gerak lurus, gerak miring atau gerak parabola. Temannya energi kinetik translasi adalah energi kinetik rotasi. Energi kinetik rotasi = energi kinetik yang dimiliki oleh benda atau molekul yang melakukan gerak rotasi.
Kedua, energi kinetik translasi rata‐rata pada persamaan di atas hanya berlaku untuk gas monoatomik saja. Contoh gas monoatomik adalah He (helium), Ar (Argon) dll. Selain gas monoatomik, terdapat juga gas diatomik. Contoh gas diatomik adalah O2 (oksigen), N2 (nitrogen), CO (karbon monooksida) dll. Ada juga gas poliatomik. Contohnya CO2 (karbondioksida) dll. Gas monoatomik terdiri dari satu atom saja, gas diatomik terdiri dari dua atom dan gas poliatomik terdiri dari banyak atom.
Ketiga, suhu mutlak harus dinyatakan dalam skala Klevin (K). Kalau suhu masih dalam skala Celcius (oC), ubah terlebih dahulu ke dalam skala Kelvin (K).
Keempat, persamaan 1 dan persamaan 2 di atas tidak hanya berlaku pada zat gas saja, tetapi juga berlaku pada zat cair dan zat gas.
Contoh soal :
Berapa energi kinetik translasi rata‐rata dari molekul‐molekul dalam gas pada suhu 40 oC ?
Pembahasan


0 Response to "√Energi Dalam Gas Ideal ⊗ Full Pembahasanya"
Posting Komentar