√Kecepatan Efektif Gas ⊗ Full Pembahasanya
Kecepatan efektif gas
Pada atmosfir planet bumi tidak ada gas helium dan hidrogen bebas. Yang ada hanya nitrogen (78 %), oksigen (21 %), argon (0,90 %), karbondioksida dll. Atmosfir Venus hampir seluruhnya berisi karbondioksida (CO2). Atmosfir Yupiter mempunyai banyak helium dan hidrogen bebas. Bulan tidak mempunyai atmosfir. Mengapa jenis atmosfir setiap planet berbeda‐beda ? Mengapa helium dan hidrogen bebas tidak ada di atmosfir bumi ?
Kecepatan akar kuadrat rata‐rata = root mean square = vrms. Kita bisa menurunkan persamaan vrms dengan mengubah persamaan Suhu dan Energi Kinetik translasi.


Keterangan :
v rms = kecepatan atau laju akar kuadrat rata‐rata (m/s)
k = Konstanta Boltzman n (k = 1,38 x 10‐23 J/K)
T = Suhu mutlak (K = Kelvin)
m = massa (kg)

Keterangan :
v rms = kecepatan atau laju akar kuadrat rata‐rata (m/s)
R = Konstanta gas universal (R = 8,315 J/mol.K = 8315 kJ/kmol.K)
NA = Jumlah molekul per mol = bilangan avogadro (NA = 6,02 x 1023 /mol = 6,02 x 1026 /kmol)
T = suhu (K)
M = massa molekul = massa molar (kg/kmol atau gram/mol)
v rms yang telah diturunkan di atas merupakan laju rata‐rata dari molekul‐molekul dalam gas. Ada molekul yang lajunya lebih besar dari v rms , ada juga molekul yang lajunya lebih kecil dari v rms. Pada tahun 1859, James Clerk Maxwell (1831‐1879) berhasil menemukan distribusi laju molekul‐molekul dalam gas secara teoritis. Distribusi laju molekul temuan Maxwell ini diperoleh berdasarkan teori kinetik, karenanya lebih tepat untuk molekul‐molekul gas ideal. Distribusi laju molekul Maxwell tampak seperti grafik di bawah.
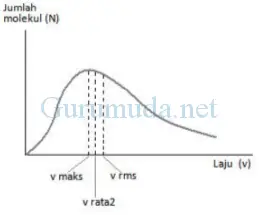 Pada tahun 1920, beberapa ilmuwan melakukan percobaan untuk menyelidiki distribusi laju molekul‐molekul gas ril alias gas nyata. Ternyata distribusi laju molekul gas ril yang ditemukan melalui percobaan persis seperti temuan Maxwell.
Pada tahun 1920, beberapa ilmuwan melakukan percobaan untuk menyelidiki distribusi laju molekul‐molekul gas ril alias gas nyata. Ternyata distribusi laju molekul gas ril yang ditemukan melalui percobaan persis seperti temuan Maxwell.
Ketika massa jenis gas cukup tinggi, distribusi laju molekul gas ril yang diperoleh melalui eksperimen ternyata tidak cocok dengan distribusi laju molekul gas yang diturunkan oleh Maxwell secara teori. Dengan demikian, distribusi Maxwell yang didasarkan pada teori kinetik gas menggunakan mekanika Newton bersifat terbatas. Distribusi laju molekul gas pada kerapatan yang tinggi bisa dijelaskan dengan prinsip‐prinsip kuantum.
Distribusi laju molekul gas ril yang diperoleh melalui percobaan tampak seperti gambar di bawah.
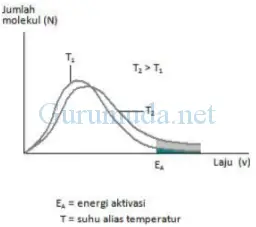 Gambar ini menunjukkan distribusi laju molekul gas ril untuk dua suhu yang berbeda. Grafik distribusi laju molekul yang diperoleh melalui percobaan ini cocok dengan persamaan v rms di atas (v rms berbanding lurus dengan suhu). Karena v rms berbanding lurus dengan suhu maka ketika suhu semakin meningkat (T2), kurva distribusi laju molekul semakin bergeser ke kanan (v rms makin besar). EA (energi aktivasi) merupakan energi kinetik minimum yang diperlukan untuk terjadinya reaksi kimia.
Gambar ini menunjukkan distribusi laju molekul gas ril untuk dua suhu yang berbeda. Grafik distribusi laju molekul yang diperoleh melalui percobaan ini cocok dengan persamaan v rms di atas (v rms berbanding lurus dengan suhu). Karena v rms berbanding lurus dengan suhu maka ketika suhu semakin meningkat (T2), kurva distribusi laju molekul semakin bergeser ke kanan (v rms makin besar). EA (energi aktivasi) merupakan energi kinetik minimum yang diperlukan untuk terjadinya reaksi kimia.
Dari grafik di atas, tampak bahwa semakin tinggi suhu, jumlah molekul yang memiliki energi kinetik lebih besar daripada energi aktivasi (EA ). Ini yang menjadi alasan, mengapa semakin tinggi suhu, semakin cepat terjadinya reaksi kimia. Semakin tinggi suhu, energi kinetik molekul juga semakin besar. Karena energi kinetik molekul besar, maka ketika terjadi tumbukan, molekul‐molekul tersebut bisa saling menempel.
Contoh soal 1 :
Tentukan v rms dari molekul Nitrogen (N2) dalam udara yang bersuhu 20 oC (massa molekul Nitrogen = 28 gram/mol = 28 kg/kmol)
Pembahasan
k = 1,38 x 10‐23 J/K = 1,38 x 10‐23 (kg m2 /s2 )/K
T = 20 oC + 273 = 293 K
Massa molar atau massa molekul N2 (M) = 2 x 14 u = 2 x14 gram/mol = 28 gram/mol = 28 kg/kmol (massa atom N = 14 u. lihat tabel periodik unsur)
Jumlah molekul/mol = Bilangan Avogadro (NA) = 6,02 x 1023 /mol = 6,02 x 1026 /kmol
Massa Nitrogen (m) = ?

Laju rms Nitrogen (v rms) = ?

Contoh soal 2 :
Tentukan v rms dari Helium (He) dalam udara yang bersuhu 20 oC…. (massa molekul Helium = 4 gram/mol = 4 kg/kmol)
Pembahasan
k = 1,38 x 10‐23 J/K
T = 20 oC + 273 = 293 K
Massa molar/Massa molekul He (M) = 4 u = 4 gram/mol = 4 kg/kmol (massa atom He = 4 u. lihat tabel periodik unsur)
Jumlah molekul/mol = Bilangan Avogadro (N A ) = 6,02 x 1023 /mol = 6,02 x 1026 /kmol
Massa He (m) = ?

Laju rms He (v rms) = ?

Contoh soal 3 :
Tentukan v rms dari Hidrogen (H2) dalam udara yang bersuhu 20 oC…. (massa molekul Hidrogen = 2 gram/mol = 4 kg/kmol)
Pembahasan
k = 1,38 x 10‐23 J/K
T = 20 oC + 273 = 293 K
Massa molar/M assa molekul Hidrogen (M) = 2 x 1 u = 2 u = 2 gram/mol = 2 kg/kmol (massa atom H = 1 u. lihat tabel periodik unsur)
Jumlah molekul/mol = Bilangan Avogadro (NA) = 6,02 x 1023 /mol = 6,02 x 1026 /kmol
Massa H2 (m) = ?

Laju rms H2 (v rms) = ?

Contoh soal 4 :
Tentukan laju rms dari molekul oksigen (O2) dalam udara yang bersuhu 20 oC. (massa molekul O2 = 32 gram/mol = 44 kg/kmol)
Pembahasan
k = 1,38 x 10 ‐23 J/K
T = 20 oC + 273 = 293 K
Massa molar/Ma ssa molekul Oksigen (M) = 2 x 16 u = 32 u = 32 gram/mol = 32 kg/kmol (massa atom O = 16 u. lihat tabel periodik unsur)
Jumlah molekul/mol = Bilangan Avogadro (NA) = 6,02 x 1023 /mol = 6,02 x 1026 /kmol
Massa O2 (m) = ?
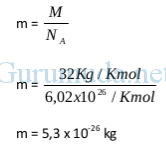
Laju rms H2 (v rms) = ?

Contoh soal 5 :
Tentukan laju rms dari molekul karbondioksida (CO2) dalam udara yang bersuhu 20 oC. (massa molekul CO2 = 44 gram/mol = 44 kg/kmol)
Pembahasan
k = 1,38 x 10‐23 J/K = 1,38 x 10‐23 (kg m2 /s2 )/K
T = 30 oC + 273 = 293 K
Massa molar/Massa molekul CO2 (M) = 12 u + (2 x 16 u) = 12 u + 32 u = 44 u = 44 gram/mol = 44 kg/kmol (massa atom C = 12 u, massa atom O = 16 u. Lihat tabel periodik unsur)
Jumlah molekul/mol = Bilangan Avogadro (NA) = 6,02 x 1023 /mol = 6,02 x 1026 /kmol
Massa CO2 (m) = ?

Laju rms CO2 (v rms ) = ?

Sekarang mari kita bandingkan v rms beberapa jenis gas :
v rms Hidrogen (H2) = 1917 m/s = 1,92 km/s (pada suhu 20 oC)
v rms Helium (He) = 1355,7 m/s = 1,36 km/s (pada suhu 20 oC)
v rms Nitrogen (N2) = 510,75 m/s = 0,51 km/s (pada suhu 20 oC)
v rms Oks igen (O2) = 478,4 m/s = 0,48 km/s (pada suhu 20 oC)
v rms karbondioksida (CO2) = 407,6 m/s = 0,41 km/s (pada suhu 20 oC)
Gas yang memiliki laju rms terbesar adalah Hidrogen dan yang terkecil adalah Karbondioksida. Sekarang coba bandingkan dengan kelajuan lepas di permukaan bumi (kelajuan lepas = 11,2 km/s). Kelajuan lepas adalah kelajuan minimum yang diperlukan suatu benda untuk bebas dari medan gravitasi bumi
Apabila v rms molekul gas hanya 1/6 kali kelajuan lepas (1/6 x 11,2 km/s = 1,86 km/s), maka cukup banyak molekul gas yang kelajuannya lebih besar dari kelajuan lepas (ingat distribusi laju molekul yang sudah dijelaskan di atas). Pada suhu 20 oC, v rms gas Hidrogen = 1,92 km/s (> 1,86 km/s). Sedangkan v rms gas helium pada suhu 20 oC = 1,36 km/jam (mendekati 1,86 km/ s). Ini pada suhu 20 oC.
Semakin besar suhu, semakin besar v rms. Semakin besar v rms, semakin besar peluang keluar dari medan gravitasi bumi. Ini merupakan alasan mengapa Helium dan Hidrogen bebas tidak ada di atmosfir bumi.
Besarnya kelajuan lepas planet dan laju rms molekul gas menentukan jenis atmosfir yang dimiliki oleh suatu planet atau satelit. Kelajuan lepas planet venus = 10,3 km/s. v rms CO2 sangat kecil sehingga sulit keluar dari atmosfir Venus. Sedangkan kelajuan lepas Yupiter = 60 km/s, cukup besar karena diameter Yupiter besar. Karenanya hidrogen dan helium tidak bisa lepas dari medan gravitasi Yupiter.
Kecepatan efektif gas
Pada atmosfir planet bumi tidak ada gas helium dan hidrogen bebas. Yang ada hanya nitrogen (78 %), oksigen (21 %), argon (0,90 %), karbondioksida dll. Atmosfir Venus hampir seluruhnya berisi karbondioksida (CO2). Atmosfir Yupiter mempunyai banyak helium dan hidrogen bebas. Bulan tidak mempunyai atmosfir. Mengapa jenis atmosfir setiap planet berbeda‐beda ? Mengapa helium dan hidrogen bebas tidak ada di atmosfir bumi ?
Kecepatan akar kuadrat rata‐rata = root mean square = vrms. Kita bisa menurunkan persamaan vrms dengan mengubah persamaan Suhu dan Energi Kinetik translasi.


Keterangan :
v rms = kecepatan atau laju akar kuadrat rata‐rata (m/s)
k = Konstanta Boltzman n (k = 1,38 x 10‐23 J/K)
T = Suhu mutlak (K = Kelvin)
m = massa (kg)

Keterangan :
v rms = kecepatan atau laju akar kuadrat rata‐rata (m/s)
R = Konstanta gas universal (R = 8,315 J/mol.K = 8315 kJ/kmol.K)
NA = Jumlah molekul per mol = bilangan avogadro (NA = 6,02 x 1023 /mol = 6,02 x 1026 /kmol)
T = suhu (K)
M = massa molekul = massa molar (kg/kmol atau gram/mol)
v rms yang telah diturunkan di atas merupakan laju rata‐rata dari molekul‐molekul dalam gas. Ada molekul yang lajunya lebih besar dari v rms , ada juga molekul yang lajunya lebih kecil dari v rms. Pada tahun 1859, James Clerk Maxwell (1831‐1879) berhasil menemukan distribusi laju molekul‐molekul dalam gas secara teoritis. Distribusi laju molekul temuan Maxwell ini diperoleh berdasarkan teori kinetik, karenanya lebih tepat untuk molekul‐molekul gas ideal. Distribusi laju molekul Maxwell tampak seperti grafik di bawah.
 Pada tahun 1920, beberapa ilmuwan melakukan percobaan untuk menyelidiki distribusi laju molekul‐molekul gas ril alias gas nyata. Ternyata distribusi laju molekul gas ril yang ditemukan melalui percobaan persis seperti temuan Maxwell.
Pada tahun 1920, beberapa ilmuwan melakukan percobaan untuk menyelidiki distribusi laju molekul‐molekul gas ril alias gas nyata. Ternyata distribusi laju molekul gas ril yang ditemukan melalui percobaan persis seperti temuan Maxwell.
Ketika massa jenis gas cukup tinggi, distribusi laju molekul gas ril yang diperoleh melalui eksperimen ternyata tidak cocok dengan distribusi laju molekul gas yang diturunkan oleh Maxwell secara teori. Dengan demikian, distribusi Maxwell yang didasarkan pada teori kinetik gas menggunakan mekanika Newton bersifat terbatas. Distribusi laju molekul gas pada kerapatan yang tinggi bisa dijelaskan dengan prinsip‐prinsip kuantum.
Distribusi laju molekul gas ril yang diperoleh melalui percobaan tampak seperti gambar di bawah.
 Gambar ini menunjukkan distribusi laju molekul gas ril untuk dua suhu yang berbeda. Grafik distribusi laju molekul yang diperoleh melalui percobaan ini cocok dengan persamaan v rms di atas (v rms berbanding lurus dengan suhu). Karena v rms berbanding lurus dengan suhu maka ketika suhu semakin meningkat (T2), kurva distribusi laju molekul semakin bergeser ke kanan (v rms makin besar). EA (energi aktivasi) merupakan energi kinetik minimum yang diperlukan untuk terjadinya reaksi kimia.
Gambar ini menunjukkan distribusi laju molekul gas ril untuk dua suhu yang berbeda. Grafik distribusi laju molekul yang diperoleh melalui percobaan ini cocok dengan persamaan v rms di atas (v rms berbanding lurus dengan suhu). Karena v rms berbanding lurus dengan suhu maka ketika suhu semakin meningkat (T2), kurva distribusi laju molekul semakin bergeser ke kanan (v rms makin besar). EA (energi aktivasi) merupakan energi kinetik minimum yang diperlukan untuk terjadinya reaksi kimia.
Dari grafik di atas, tampak bahwa semakin tinggi suhu, jumlah molekul yang memiliki energi kinetik lebih besar daripada energi aktivasi (EA ). Ini yang menjadi alasan, mengapa semakin tinggi suhu, semakin cepat terjadinya reaksi kimia. Semakin tinggi suhu, energi kinetik molekul juga semakin besar. Karena energi kinetik molekul besar, maka ketika terjadi tumbukan, molekul‐molekul tersebut bisa saling menempel.
Contoh soal 1 :
Tentukan v rms dari molekul Nitrogen (N2) dalam udara yang bersuhu 20 oC (massa molekul Nitrogen = 28 gram/mol = 28 kg/kmol)
Pembahasan
k = 1,38 x 10‐23 J/K = 1,38 x 10‐23 (kg m2 /s2 )/K
T = 20 oC + 273 = 293 K
Massa molar atau massa molekul N2 (M) = 2 x 14 u = 2 x14 gram/mol = 28 gram/mol = 28 kg/kmol (massa atom N = 14 u. lihat tabel periodik unsur)
Jumlah molekul/mol = Bilangan Avogadro (NA) = 6,02 x 1023 /mol = 6,02 x 1026 /kmol
Massa Nitrogen (m) = ?

Laju rms Nitrogen (v rms) = ?

Contoh soal 2 :
Tentukan v rms dari Helium (He) dalam udara yang bersuhu 20 oC…. (massa molekul Helium = 4 gram/mol = 4 kg/kmol)
Pembahasan
k = 1,38 x 10‐23 J/K
T = 20 oC + 273 = 293 K
Massa molar/Massa molekul He (M) = 4 u = 4 gram/mol = 4 kg/kmol (massa atom He = 4 u. lihat tabel periodik unsur)
Jumlah molekul/mol = Bilangan Avogadro (N A ) = 6,02 x 1023 /mol = 6,02 x 1026 /kmol
Massa He (m) = ?

Laju rms He (v rms) = ?

Contoh soal 3 :
Tentukan v rms dari Hidrogen (H2) dalam udara yang bersuhu 20 oC…. (massa molekul Hidrogen = 2 gram/mol = 4 kg/kmol)
Pembahasan
k = 1,38 x 10‐23 J/K
T = 20 oC + 273 = 293 K
Massa molar/M assa molekul Hidrogen (M) = 2 x 1 u = 2 u = 2 gram/mol = 2 kg/kmol (massa atom H = 1 u. lihat tabel periodik unsur)
Jumlah molekul/mol = Bilangan Avogadro (NA) = 6,02 x 1023 /mol = 6,02 x 1026 /kmol
Massa H2 (m) = ?

Laju rms H2 (v rms) = ?

Contoh soal 4 :
Tentukan laju rms dari molekul oksigen (O2) dalam udara yang bersuhu 20 oC. (massa molekul O2 = 32 gram/mol = 44 kg/kmol)
Pembahasan
k = 1,38 x 10 ‐23 J/K
T = 20 oC + 273 = 293 K
Massa molar/Ma ssa molekul Oksigen (M) = 2 x 16 u = 32 u = 32 gram/mol = 32 kg/kmol (massa atom O = 16 u. lihat tabel periodik unsur)
Jumlah molekul/mol = Bilangan Avogadro (NA) = 6,02 x 1023 /mol = 6,02 x 1026 /kmol
Massa O2 (m) = ?

Laju rms H2 (v rms) = ?

Contoh soal 5 :
Tentukan laju rms dari molekul karbondioksida (CO2) dalam udara yang bersuhu 20 oC. (massa molekul CO2 = 44 gram/mol = 44 kg/kmol)
Pembahasan
k = 1,38 x 10‐23 J/K = 1,38 x 10‐23 (kg m2 /s2 )/K
T = 30 oC + 273 = 293 K
Massa molar/Massa molekul CO2 (M) = 12 u + (2 x 16 u) = 12 u + 32 u = 44 u = 44 gram/mol = 44 kg/kmol (massa atom C = 12 u, massa atom O = 16 u. Lihat tabel periodik unsur)
Jumlah molekul/mol = Bilangan Avogadro (NA) = 6,02 x 1023 /mol = 6,02 x 1026 /kmol
Massa CO2 (m) = ?

Laju rms CO2 (v rms ) = ?

Sekarang mari kita bandingkan v rms beberapa jenis gas :
v rms Hidrogen (H2) = 1917 m/s = 1,92 km/s (pada suhu 20 oC)
v rms Helium (He) = 1355,7 m/s = 1,36 km/s (pada suhu 20 oC)
v rms Nitrogen (N2) = 510,75 m/s = 0,51 km/s (pada suhu 20 oC)
v rms Oks igen (O2) = 478,4 m/s = 0,48 km/s (pada suhu 20 oC)
v rms karbondioksida (CO2) = 407,6 m/s = 0,41 km/s (pada suhu 20 oC)
Gas yang memiliki laju rms terbesar adalah Hidrogen dan yang terkecil adalah Karbondioksida. Sekarang coba bandingkan dengan kelajuan lepas di permukaan bumi (kelajuan lepas = 11,2 km/s). Kelajuan lepas adalah kelajuan minimum yang diperlukan suatu benda untuk bebas dari medan gravitasi bumi
Apabila v rms molekul gas hanya 1/6 kali kelajuan lepas (1/6 x 11,2 km/s = 1,86 km/s), maka cukup banyak molekul gas yang kelajuannya lebih besar dari kelajuan lepas (ingat distribusi laju molekul yang sudah dijelaskan di atas). Pada suhu 20 oC, v rms gas Hidrogen = 1,92 km/s (> 1,86 km/s). Sedangkan v rms gas helium pada suhu 20 oC = 1,36 km/jam (mendekati 1,86 km/ s). Ini pada suhu 20 oC.
Semakin besar suhu, semakin besar v rms. Semakin besar v rms, semakin besar peluang keluar dari medan gravitasi bumi. Ini merupakan alasan mengapa Helium dan Hidrogen bebas tidak ada di atmosfir bumi.
Besarnya kelajuan lepas planet dan laju rms molekul gas menentukan jenis atmosfir yang dimiliki oleh suatu planet atau satelit. Kelajuan lepas planet venus = 10,3 km/s. v rms CO2 sangat kecil sehingga sulit keluar dari atmosfir Venus. Sedangkan kelajuan lepas Yupiter = 60 km/s, cukup besar karena diameter Yupiter besar. Karenanya hidrogen dan helium tidak bisa lepas dari medan gravitasi Yupiter.
Kelembaban
Kelembaban menyatakan banyaknya kandungan uap air pada udara. Ketika hujan turun, udara sangat lembab karena kandungan uap air dalam udara sangat banyak. Sebaliknya, jika kandungan uap air dalam udara sangat sedikit atau nyaris tidak ada, udara sangat kering. Banyaknya kandungan uap air dalam udara dinyatakan dengan kelembaban relatif.
Kelembaban relatif merupakan perbandingan tekanan parsial uap dengan tekanan uap jenuh air pada suhu tertentu (yang dimaksudkan dengan uap di sini adalah uap air). Kelembaban relatif dinyatakan dalam persen, secara matematis dirumuskan sebagai berikut :
![]()
Ada sebuah istilah baru, yakni tekanan parsial. Tekanan parsial merupakan tekanan yang diberikan oleh setiap gas yang ada dalam udara. Udara sebenarnya terdiri dari berbagai jenis gas… ada nitrogen (78 %), oksigen (21 %), argon (0,90 %), karbondioksida, uap air dll.. Jumlah tekanan parsial dari setiap gas dalam udara disebut tekanan total (tekanan total = tekanan atmosfir = tekanan udara). Jika tidak ada kandungan uap air dalam udara, maka tekanan parsial uap air = 0. Sebaliknya, tekanan parsial uap air bernilai maksimum jika tekanan parsial uap air = tekanan uap jenuh air. Tekanan uap jenuh air bergantung pada suhu (lihat table di atas).
Apabila tekanan parsial uap air = tekanan uap jenuh (kelembaban relatif = 100 %), maka udara menjadi jenuh dengan uap air… Pada saat udara menjadi jenuh dengan uap air, kandungan uap air dalam udara hampir mencapai nilai maksimum… Apabila tekanan parsial uap air > tekanan uap jenuh (kelembaban relatif > 100%), maka udara menjadi superjenuh… Pada saat udara menjadi super jenuh, udara sudah tidak mampu menahan kandungan uap air… Karena udara sudah tidak mampu menahan kandungan uap air maka kelebihan uap air akan berkondensasi menjadi air (baca : embun)… Suhu di mana uap air berkondensasi menjadi embun disebut titik embun.

0 Response to "√Kecepatan Efektif Gas ⊗ Full Pembahasanya"
Posting Komentar