√Pembahasan Soal Tekanan Udara ⊗ Full Pembahasanya
Pembahasan soal tekanan udara
1. EBTANAS-SMP-00-05
Besar tekanan udara di ruang tertutup P dapat ditulis dalam bentuk persamaan …
A. (76/h) cmHg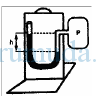
B. (76 + h) cmHg
C. (76 × h) cmHg
D. (76 – h) cmHg
Pembahasan
Tekanan udara tepat di atas permukaan laut adalah 76 cmHg. Ini artinya tepat di atas permukaan air laut, kolom air raksa (Hg) pada manometer (alat ukur tekanan udara) naik setinggi 76 cm. 76 cmHg dikenal juga sebagai nilai tekanan udara di sekitar permukaan bumi.
Jika ujung atas pipa kiri terbuka maka terdapat udara yang berada tepat di atas zat cair dalam pipa kiri, di mana udara ini memberikan tekanan ke zat cair. Karena alat pada gambar dianggap berada di sekitar permukaan bumi maka udara pada permukaan atas pipa kiri memberikan tekanan sebesar 76 cmHg. Zat cair yang berada di dalam tabung merupakan air raksa, di mana pada gambar tampak mempunyai perbedaan ketinggian sebesar h cm (h cmHg).
Dengan demikian dapat disimpulkan bahwa tekanan udara pada ruang tertutup merupakan jumlah dari tekanan udara 76 cmHg dan selisih ketinggian air raksa (h cmHg). Secara matematis :
P = 76 cmHg + h cmHg
Jawaban yang benar adalah B.
Pembahasan soal tekanan udara
1. EBTANAS-SMP-00-05
Besar tekanan udara di ruang tertutup P dapat ditulis dalam bentuk persamaan …
A. (76/h) cmHg
B. (76 + h) cmHg
C. (76 × h) cmHg
D. (76 – h) cmHg
Pembahasan
Tekanan udara tepat di atas permukaan laut adalah 76 cmHg. Ini artinya tepat di atas permukaan air laut, kolom air raksa (Hg) pada manometer (alat ukur tekanan udara) naik setinggi 76 cm. 76 cmHg dikenal juga sebagai nilai tekanan udara di sekitar permukaan bumi.
Jika ujung atas pipa kiri terbuka maka terdapat udara yang berada tepat di atas zat cair dalam pipa kiri, di mana udara ini memberikan tekanan ke zat cair. Karena alat pada gambar dianggap berada di sekitar permukaan bumi maka udara pada permukaan atas pipa kiri memberikan tekanan sebesar 76 cmHg. Zat cair yang berada di dalam tabung merupakan air raksa, di mana pada gambar tampak mempunyai perbedaan ketinggian sebesar h cm (h cmHg).
Dengan demikian dapat disimpulkan bahwa tekanan udara pada ruang tertutup merupakan jumlah dari tekanan udara 76 cmHg dan selisih ketinggian air raksa (h cmHg). Secara matematis :
P = 76 cmHg + h cmHg
Jawaban yang benar adalah B.
Pembahasan soal teori kinetik gas
1. Soal UN 2007/2008 P4 No.19
Tekanan gas ideal di dalam ruang tertutup terhadap dinding tabung dirumuskan :
P = 2N/3V EK
P = tekanan (Pa)
N = jumlah molekul (partikel) gas
V = volume gas
EK = energi kinetik rata-rata molekul (J).
Pernyataan yang benar terkait rumusan di atas adalah…
A. Tekanan gas terhadap dinding tergantung pada jumlah molekul per satuan volume
B. Energi kinetik gas tidak tergantung pada tekanan yang ditimbulkan molekul terhadap dinding
C. Volume gas dalam tabung tidak berubah jika tekanan gas berubah
D. Jumlah molekul gas berkurang maka energi kinetik molekul akan bertambah
E. Volume gas bertambah maka jumlah molekul gas bertambah
Pembahasan
Ruangan tertutup sehingga walaupun tekanan gas berubah, volume gas dalam tabung tidak berubah.
Jawaban yang benar adalah C.
2. Soal UN 2007/2008
Tekanan gas ideal di dalam ruang tertutup terhadap dinding tabung dirumuskan sebagai P = (2N / 3V) EK. P = tekanan (Pa), N = jumlah molekul (partikel) gas dan EK adalah energi kinetik rata-rata molekul (J). Berdasarkan persamaan ini, pernyataan yang benar adalah …
A. Tekanan gas terhadap dinding bergantung pada energi kinetik rata-rata molekul
B. Energi kinetik gas bergantung pada tekanan yang ditimbulkan molekul terhadap dinding
C. Suhu gas dalam tabung akan berubah jika tekanan gas berubah
D. Jika jumlah molekul gas berkurang maka volume energi kinetik molekul akan berkurang
E. Jika volume gas bertambah maka tekanan gas akan berkurang
Pembahasan
Diketahui :
Rumus tekanan : P = (2N / 3V) EK
P = tekanan
N = jumlah molekul partikel gas
V = volume gas
EK = energi kinetik rata-rata
P berbanding lurus dengan N dan EK
P berbanding terbalik dengan V
N berbanding lurus dengan volume
N berbanding terbalik dengan EK
Ditanya : Pernyataan yang benar
Jawab :
A salah karena berdasarkan rumus di atas, tekanan gas (P) bergantung pada energi kinetik, bukan energi kinetik rata-rata.
B salah karena tekanan bergantung pada energi kinetik gas, bukan sebaliknya.
C salah karena berdasarkan rumus di atas, suhu tidak bergantung pada tekanan
D salah karena N berbanding terbalik dengan EK, artinya jika N besar maka EK besar.
E benar karena tekanan (P) berbanding terbalik dengan volume (V).
Jawaban yang benar adalah E.
3. Soal UN 2008/2009 P04 No.16
Gas ideal yang berada dalam suatu bejana dimampatkan (ditekan), maka gas akan mengalami….
A. Penurunan laju partikel
B. Penurunan suhu
C. Kenaikan suhu
D. Penambahan partikel gas
E. Penurunan partikel gas
Pembahasan
Hukum gas ideal (dalam jumlah mol) :
PV = nRT
Hukum gas ideal (dalam jumlah molekul) :
PV = NkT
Hubungan antara energi kinetik dan suhu gas :
EK = 3/2 kT
Keterangan :
P = tekanan, V = volume, T = suhu, n = jumlah mol, N = jumlah molekul, R = konstanta umum gas, k = konstanta Boltzmann
Berdasarkan tiga rumus di atas, disimpulkan sebagai berikut :
– Jika gas ditekan maka volume (V) gas berkurang.
– Jika volume (V) gas berkurang maka tekanan (P) gas bertambah dan suhu (T) gas bertambah.
– Ruangan tertutup (V konstan) karenanya jumlah mol gas (n) dan jumlah partikel gas (N) tidak berubah.
– Jika suhu (T) gas bertambah maka energi kinetik (EK) gas bertambah. Jika energi kinetik gas bertambah maka kecepatan gerak partikel gas bertambah (EK = ½ m v2, v = kelajuan).
Jawaban yang benar adalah C.
4. Soal UN 2008/2009 P04 No.17
Sejumlah gas ideal dalam tabung tertutup dipanaskan secara isokhorik sehingga suhunya naik menjadi empat kali suhu semula. Energi kinetik rata-rata molekul gas ideal menjadi….
A. ¼ kali semula
B. ½ kali semula
C. Sama dengan semula
D. 2 kali semula
E. 4 kali semula
Pembahasan
Isokhorik = volume konstan
Hubungan antara energi kinetik rata-rata (EK) dan suhu (T) gas dinyatakan melalui persamaan di bawah :
EK = 3/2 kT
Keterangan : EK = energi kinetik, T = suhu, 3/2 = konstanta, k = konstanta Boltzmann.
Berdasarkan rumus ini tampak bahwa energi kinetik berbanding lurus dengan suhu. Jadi semakin besar suhu, semakin besar energi kinetik. Jika suhu naik menjadi empat kali semula maka energi kinetik juga naik menjadi empat kali semula.
Jawaban yang benar adalah E.
5. Soal UN 2008/2009 P45 No.14
Suatu gas ideal dengan tekanan P dan volume V dalam ruang tertutup. Jika tekanan gas dalam ruang tersebut diturunkan menjadi 1/4 kali semula pada volume tetap, maka perbandingan energi kinetik sebelum dan sesudah penurunan tekanan adalah…
A. 1 : 4
B. 1 : 2
C. 2 : 1
D. 4 : 1
E. 5 : 1
Pembahasan
Diketahui :
Volume awal = V
Volume akhir = V
Tekanan awal gas = P
Tekanan akhir gas = ¼ P
Ditanya : perbandingan energi kinetik awal dan energi kinetik akhir (EK1 : EK2)
Jawab :
Hubungan antara tekanan (P), volume (V) dan energi kinetik (EK) gas :

Perbandingan energi kinetik awal dan energi kinetik akhir :

Jawaban yang benar adalah D.
6. Soal UN 2009/2010 P70 No.16
Suhu gas ideal dalam tabung dirumuskan sebagai EK = 3/2 kT, T menyatakan suhu mutlak dan EK = energi kinetik rata-rata molekul gas. Beradasarkan persamaan di atas…
A. Semakin tinggi suhu gas, energi kinetiknya semakin kecil
B. Semakin tinggi suhu gas, gerak partikel gas semakin lambat
C. Semakin tinggi suhu gas, gerak partikel gas semakin cepat
D. Suhu gas berbanding terbalik dengan energi kinetik gas
E. Suhu gas tidak mempengaruhi gerak partikel gas
Pembahasan
Berdasarkan rumus di atas, suhu berbanding lurus dengan energi kinetik. Semakin tinggi suhu, semakin besar energi kinetik. Energi kinetik sebanding dengan kecepatan gerak partikel gas (EK = ½ m v2, di mana EK = energi kinetik, v = kecepatan). Semakin besar energi kinetik, semakin cepat gerakan partikel gas.
Jawaban yang benar adalah C.
7. Soal UN 2010/2011 P12 No.4
Faktor yang mempengaruhi energi kinetik gas di dalam ruang tertutup :
(1) tekanan
(2) volume
(3) suhu
(4) jenis zat
Pernyataan yang benar adalah….
A. (1) dan (2)
B. (1) dan (3)
C. (1) dan (4)
D. (2) saja
E. (3) saja
Pembahasan
Ruang tertutup karenanya volume gas konstan, volume gas tidak mempengaruhi energi kinetik.
Jawaban yang benar adalah B.
Teori kinetik gas 91.15 KB

0 Response to "√Pembahasan Soal Tekanan Udara ⊗ Full Pembahasanya"
Posting Komentar