√Hukum Boyle, Hukum Charles Dan Hukum Gay?Lussac ⊗ Full Pembahasanya
Hukum Boyle, Hukum Charles dan HukumGay‐Lussac
Hukum Boyle
Robert Boyle (1627‐1691) melakukan eksperimen untuk menyelidiki hubungan kuantitatif antara tekanan dan volume gas. Percobaan ini dilakukan dengan memasukkan sejumlah gas tertentu ke dalam sebuah wadah tertutup. Sampai pendekatan yang cukup baik, Ia menemukan bahwa apabila suhu gas dijaga konstan, maka ketika tekanan gas bertambah, volume gas berkurang. Demikian juga sebaliknya ketika tekanan gas berkurang, volume gas bertambah. Tekanan gas berbanding terbalik dengan volume gas. Hubungan ini dikenal dengan julukan Hukum Boyle. Secara matematis :

Hukum Boyle juga bisa ditulis :
PV = konstan → persamaan 1
P1 V1 = P2 V2 → persamaan 2
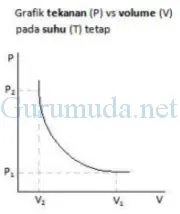 Arti dari persamaan 1 adalah pada suhu (T) konstan, apabila tekanan (P) gas berubah maka volume (V) gas juga berubah sehingga hasil kali antara tekanan dan volume selalu konstan. Apabila tekanan gas bertambah, volume gas berkurang atau sebaliknya jika tekanan gas berkurang maka volume gas bertambah, sehingga hasil kali antara tekanan dan volume selalu konstan.
Arti dari persamaan 1 adalah pada suhu (T) konstan, apabila tekanan (P) gas berubah maka volume (V) gas juga berubah sehingga hasil kali antara tekanan dan volume selalu konstan. Apabila tekanan gas bertambah, volume gas berkurang atau sebaliknya jika tekanan gas berkurang maka volume gas bertambah, sehingga hasil kali antara tekanan dan volume selalu konstan.
Grafik yang menyatakan hubungan antara volume dan tekanan tampak seperti pada gambar di bawah. Berdasarkan hasil percobaannya, Robert Boyle menemukan bahwa volume gas mengalami perubahan secara tidak teratur sehingga garis pada grafik kelihatan melengkung. Tekanan yang diganbarkan pada grafik merupakan adalah tekanan absolut, bukan tekanan ukur.
Hukum Charles
Seratus tahun setelah Robert Boyle menemukan hubungan antara volume dan tekanan, ilmuwan berkebangsaan Perancis yang bernama Jacques Charles (1746‐1823) menyelidiki hubungan antara suhu dan volume gas. Berdasarkan hasil percobaannya, Ia menemukan apabila tekanan gas selalu konstan, maka ketika suhu gas bertambah, volume gas juga bertambah. Sebaliknya ketika suhu gas berkurang, volume gas juga berkurang.
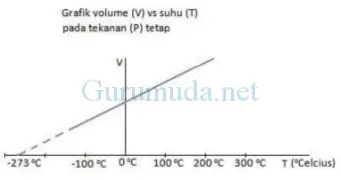
Perubahan volume gas akibat adanya perubahan suhu, terjadi secara teratur sehingga garis pada grafik ini tampak lurus. Apabila garis pada grafik digambarkan sampai suhu yang lebih rendah maka garis akan memotong sumbu di sekitar ‐273 oC.
Berdasarkan banyak percobaan yang pernah dilakukan, ditemukan bahwa walaupun besarnya perubahan volume setiap gas berbeda‐beda, tetapi ketika garis pada grafik V‐T digambarkan sampai suhu yang lebih rendah maka garis selalu memotong sumbu di sekitar -273 oC. Kita bisa mengatakan bahwa seandainya gas didinginkan sampai ‐273 oC maka volume gas = 0. Apabila gas didinginkan lagi hingga suhunya berada di bawah ‐273 oC maka volume gas akan bernilai negatif, sesuatu yang tidak mungkin.
Jadi ‐273 oC merupakan suhu terendah yang bisa dicapai. Karena garis memotong sumbu di sekitar ‐273 oC maka sesuai dengan kesepakatan bersama, di tetapkan bahwa suhu terendah yang bisa dicapai adalah ‐273,15 oC. ‐273,15 oC disebut suhu nol mutlak dan dijadikan acuan skala mutlak alias skala Kelvin. Kelvin adalah nama Lord Kelvin (1824‐1907), fisikawan Inggris. Pada skala ini, suhu dinyatakan dalam Kelvin (K), bukan derajat Kelvin (oK). Jarak antara derajat sama seperti pada skala celcius. 0 K = ‐273,15 oC dan 273,15 K = 0 oC.
 Suhu dalam skala Celcius dapat diubah menjadi skala Kelvin dengan menambahkan 273,15, suhu dalam skala Kelvin bisa diubah menjadi skala Celcius dengan mengurangi 273,15. Secara matematis :
Suhu dalam skala Celcius dapat diubah menjadi skala Kelvin dengan menambahkan 273,15, suhu dalam skala Kelvin bisa diubah menjadi skala Celcius dengan mengurangi 273,15. Secara matematis :
T (K) = T (oC) + 273,15
T (oC) = T (K) ‐ 273,15
Keterangan :
T = Temperatur alias suhu
K = Kelvin
C = Celcius
Jika suhu dinyatakan dalam skala Kelvin maka grafik di atas akan tampak seperti gambar di bawah.
Berdasarkan grafik ini bisa disimpulkan bahwa pada tekanan tetap, volume gas selalu berbanding lurus dengan suhu mutlak gas. Apabila suhu mutlak gas bertambah maka volume gas juga bertambah, sebaliknya apabila suhu mutlak gas berkurang maka volume gas juga berkurang. Hubungan ini dikenal dengan julukan hukum Charles. Secara matematis ditulis sebagai berikut :
Volume ∝ Suhu → Tekanan konstan
V ∝ T → P konstan
Hukum Charles juga bisa ditulis seperti ini :

Arti dari persamaan 1 adalah pada tekanan (P) konstan, apabila suhu mutlak (T) gas berubah maka volume (V) gas juga berubah sehingga hasil perbandingan antara suhu mutlak dan volume selalu konstan. Jika suhu mutlak gas bertambah, maka volume gas juga bertambah atau sebaliknya jika suhu mutlak gas berkurang maka volume gas juga berkurang, sehingga hasil perbandingan antara suhu dan volume selalu konstan. Yang dimaksudkan dengan suhu mutlak gas adalah suhu gas yang dinyatakan dalam skala Kelvin. Apabila suhu masih dalam skala Celcius, maka ubah terlebih dahulu ke dalam skala Kelvin.
Hukum Gay‐Lussac
Joseph Gay‐Lussac (1778‐1850) melakukan percobaan dan menemukan bahwa apabila volume gas diatur konstan, ketika tekanan gas bertambah, suhu mutlak gas pun bertambah. Demikian juga sebaliknya ketika tekanan gas berkurang, suhu mutlak gas pun berkurang. Pada volume konstan, tekanan gas berbanding lurus dengan suhu mutlak gas. Hubungan ini disebut Hukum Gay‐Lussac. Secara matematis :
Tekanan ∝ Suhu → Volume konstan
P ∝ T → V konstan
Hukum Gay‐Lussac juga bisa ditulis seperti ini :

Arti dari persamaan 1 adalah pada volume (V) konstan, apabila tekanan (P) gas berubah maka suhu mutlak (T) gas juga berubah sehingga hasil perbandingan antara tekanan dan suhu mutlak konstan. Dengan kata lain, jika tekanan gas bertambah, maka suhu mutlak gas juga bertambah atau sebaliknya jika tekanan gas berkurang maka suhu mutlak gas juga berkurang, sehingga hasil perbandingan antara tekanan dan suhu selalu konstan.
Yang dimaksudkan dengan suhu mutlak gas adalah suhu gas yang dinyatakan dalam skala Kelvin. Apabila suhu masih dalam skala Celcius, maka ubah terlebih dahulu ke dalam skala Kelvin.
Perlu diketahui bahwa hukum Boyle, hukum Charles dan hukum Gay‐Lussac memberikan hasil yang akurat apabila tekanan dan massa jenis gas tidak terlalu besar. Di samping itu, ketiga hukum tersebut juga hanya berlaku untuk gas yang suhunya tidak mendekati titik didih.
Berdasarkan kenyataan ini, bisa disimpulkan bahwa hukum Boyle, hukum Charles dan hukum Gay‐Lussac tidak bisa diterapkan untuk semua kondisi gas. Karena tidak bisa berlaku untuk semua kondisi gas ril, maka kita memerlukan konsep Gas Ideal alias gas sempurna. Gas ideal ini tidak ada dalam kehidupan sehari‐hari. Gas ideal hanya sebuah model ideal saja, mirip seperti konsep benda tegar dan fluida ideal. Jadi kita menganggap ketiga hukum gas di atas berlaku dalam semua kondisi gas ideal.
Dalam menyelesaikan soal‐soal hukum gas, suhu harus dinyatakan dalam skala Kelvin. Apabila tekanan gas masih berupa tekanan ukur, ubah terlebih dahulu menjadi tekanan absolut. Tekanan absolut = tekanan atmosfir + tekanan ukur.
Hukum Boyle, Hukum Charles dan HukumGay‐Lussac
Hukum Boyle
Robert Boyle (1627‐1691) melakukan eksperimen untuk menyelidiki hubungan kuantitatif antara tekanan dan volume gas. Percobaan ini dilakukan dengan memasukkan sejumlah gas tertentu ke dalam sebuah wadah tertutup. Sampai pendekatan yang cukup baik, Ia menemukan bahwa apabila suhu gas dijaga konstan, maka ketika tekanan gas bertambah, volume gas berkurang. Demikian juga sebaliknya ketika tekanan gas berkurang, volume gas bertambah. Tekanan gas berbanding terbalik dengan volume gas. Hubungan ini dikenal dengan julukan Hukum Boyle. Secara matematis :

Hukum Boyle juga bisa ditulis :
PV = konstan → persamaan 1
P1 V1 = P2 V2 → persamaan 2
 Arti dari persamaan 1 adalah pada suhu (T) konstan, apabila tekanan (P) gas berubah maka volume (V) gas juga berubah sehingga hasil kali antara tekanan dan volume selalu konstan. Apabila tekanan gas bertambah, volume gas berkurang atau sebaliknya jika tekanan gas berkurang maka volume gas bertambah, sehingga hasil kali antara tekanan dan volume selalu konstan.
Arti dari persamaan 1 adalah pada suhu (T) konstan, apabila tekanan (P) gas berubah maka volume (V) gas juga berubah sehingga hasil kali antara tekanan dan volume selalu konstan. Apabila tekanan gas bertambah, volume gas berkurang atau sebaliknya jika tekanan gas berkurang maka volume gas bertambah, sehingga hasil kali antara tekanan dan volume selalu konstan.
Grafik yang menyatakan hubungan antara volume dan tekanan tampak seperti pada gambar di bawah. Berdasarkan hasil percobaannya, Robert Boyle menemukan bahwa volume gas mengalami perubahan secara tidak teratur sehingga garis pada grafik kelihatan melengkung. Tekanan yang diganbarkan pada grafik merupakan adalah tekanan absolut, bukan tekanan ukur.
Hukum Charles
Seratus tahun setelah Robert Boyle menemukan hubungan antara volume dan tekanan, ilmuwan berkebangsaan Perancis yang bernama Jacques Charles (1746‐1823) menyelidiki hubungan antara suhu dan volume gas. Berdasarkan hasil percobaannya, Ia menemukan apabila tekanan gas selalu konstan, maka ketika suhu gas bertambah, volume gas juga bertambah. Sebaliknya ketika suhu gas berkurang, volume gas juga berkurang.
Perubahan volume gas akibat adanya perubahan suhu, terjadi secara teratur sehingga garis pada grafik ini tampak lurus. Apabila garis pada grafik digambarkan sampai suhu yang lebih rendah maka garis akan memotong sumbu di sekitar ‐273 oC.
Berdasarkan banyak percobaan yang pernah dilakukan, ditemukan bahwa walaupun besarnya perubahan volume setiap gas berbeda‐beda, tetapi ketika garis pada grafik V‐T digambarkan sampai suhu yang lebih rendah maka garis selalu memotong sumbu di sekitar -273 oC. Kita bisa mengatakan bahwa seandainya gas didinginkan sampai ‐273 oC maka volume gas = 0. Apabila gas didinginkan lagi hingga suhunya berada di bawah ‐273 oC maka volume gas akan bernilai negatif, sesuatu yang tidak mungkin.
Jadi ‐273 oC merupakan suhu terendah yang bisa dicapai. Karena garis memotong sumbu di sekitar ‐273 oC maka sesuai dengan kesepakatan bersama, di tetapkan bahwa suhu terendah yang bisa dicapai adalah ‐273,15 oC. ‐273,15 oC disebut suhu nol mutlak dan dijadikan acuan skala mutlak alias skala Kelvin. Kelvin adalah nama Lord Kelvin (1824‐1907), fisikawan Inggris. Pada skala ini, suhu dinyatakan dalam Kelvin (K), bukan derajat Kelvin (oK). Jarak antara derajat sama seperti pada skala celcius. 0 K = ‐273,15 oC dan 273,15 K = 0 oC.
 Suhu dalam skala Celcius dapat diubah menjadi skala Kelvin dengan menambahkan 273,15, suhu dalam skala Kelvin bisa diubah menjadi skala Celcius dengan mengurangi 273,15. Secara matematis :
Suhu dalam skala Celcius dapat diubah menjadi skala Kelvin dengan menambahkan 273,15, suhu dalam skala Kelvin bisa diubah menjadi skala Celcius dengan mengurangi 273,15. Secara matematis :
T (K) = T (oC) + 273,15
T (oC) = T (K) ‐ 273,15
Keterangan :
T = Temperatur alias suhu
K = Kelvin
C = Celcius
Jika suhu dinyatakan dalam skala Kelvin maka grafik di atas akan tampak seperti gambar di bawah.
Berdasarkan grafik ini bisa disimpulkan bahwa pada tekanan tetap, volume gas selalu berbanding lurus dengan suhu mutlak gas. Apabila suhu mutlak gas bertambah maka volume gas juga bertambah, sebaliknya apabila suhu mutlak gas berkurang maka volume gas juga berkurang. Hubungan ini dikenal dengan julukan hukum Charles. Secara matematis ditulis sebagai berikut :
Volume ∝ Suhu → Tekanan konstan
V ∝ T → P konstan
Hukum Charles juga bisa ditulis seperti ini :

Arti dari persamaan 1 adalah pada tekanan (P) konstan, apabila suhu mutlak (T) gas berubah maka volume (V) gas juga berubah sehingga hasil perbandingan antara suhu mutlak dan volume selalu konstan. Jika suhu mutlak gas bertambah, maka volume gas juga bertambah atau sebaliknya jika suhu mutlak gas berkurang maka volume gas juga berkurang, sehingga hasil perbandingan antara suhu dan volume selalu konstan. Yang dimaksudkan dengan suhu mutlak gas adalah suhu gas yang dinyatakan dalam skala Kelvin. Apabila suhu masih dalam skala Celcius, maka ubah terlebih dahulu ke dalam skala Kelvin.
Hukum Gay‐Lussac
Joseph Gay‐Lussac (1778‐1850) melakukan percobaan dan menemukan bahwa apabila volume gas diatur konstan, ketika tekanan gas bertambah, suhu mutlak gas pun bertambah. Demikian juga sebaliknya ketika tekanan gas berkurang, suhu mutlak gas pun berkurang. Pada volume konstan, tekanan gas berbanding lurus dengan suhu mutlak gas. Hubungan ini disebut Hukum Gay‐Lussac. Secara matematis :
Tekanan ∝ Suhu → Volume konstan
P ∝ T → V konstan
Hukum Gay‐Lussac juga bisa ditulis seperti ini :

Arti dari persamaan 1 adalah pada volume (V) konstan, apabila tekanan (P) gas berubah maka suhu mutlak (T) gas juga berubah sehingga hasil perbandingan antara tekanan dan suhu mutlak konstan. Dengan kata lain, jika tekanan gas bertambah, maka suhu mutlak gas juga bertambah atau sebaliknya jika tekanan gas berkurang maka suhu mutlak gas juga berkurang, sehingga hasil perbandingan antara tekanan dan suhu selalu konstan.
Yang dimaksudkan dengan suhu mutlak gas adalah suhu gas yang dinyatakan dalam skala Kelvin. Apabila suhu masih dalam skala Celcius, maka ubah terlebih dahulu ke dalam skala Kelvin.
Perlu diketahui bahwa hukum Boyle, hukum Charles dan hukum Gay‐Lussac memberikan hasil yang akurat apabila tekanan dan massa jenis gas tidak terlalu besar. Di samping itu, ketiga hukum tersebut juga hanya berlaku untuk gas yang suhunya tidak mendekati titik didih.
Berdasarkan kenyataan ini, bisa disimpulkan bahwa hukum Boyle, hukum Charles dan hukum Gay‐Lussac tidak bisa diterapkan untuk semua kondisi gas. Karena tidak bisa berlaku untuk semua kondisi gas ril, maka kita memerlukan konsep Gas Ideal alias gas sempurna. Gas ideal ini tidak ada dalam kehidupan sehari‐hari. Gas ideal hanya sebuah model ideal saja, mirip seperti konsep benda tegar dan fluida ideal. Jadi kita menganggap ketiga hukum gas di atas berlaku dalam semua kondisi gas ideal.
Dalam menyelesaikan soal‐soal hukum gas, suhu harus dinyatakan dalam skala Kelvin. Apabila tekanan gas masih berupa tekanan ukur, ubah terlebih dahulu menjadi tekanan absolut. Tekanan absolut = tekanan atmosfir + tekanan ukur.
Hukum Coulomb
Pada tulisan mengenai muatan listrik dan jenis-jenis muatan listrik diterangkan bahwa muatan listrik sejenis saling tolak menolak sedangkan muatan listrik tak sejenis saling tarik menarik. Dengan kata lain benda bermuatan positif tarik menarik dengan benda bermuatan negatif, benda bermuatan positif tolak menolak dengan benda bermuatan positif, dan benda bermuatan negatif tolak menolak dengan benda bermuatan negatif. Peristiwa ini menunjukkan adanya gaya listrik yang bekerja pada benda bermuatan positif dan benda bermuatan negatif. Faktor-faktor apa yang mempengaruhi besar gaya listrik antara benda bermuatan listrik ?
Fisikawan berkebangsaan Perancis bernama Charles Coulomb (1736-1806) melakukan serangkaian eksperimen pada tahun 1780-an untuk menyelidiki faktor-faktor yang mempengaruhi besar gaya listrik antara benda bermuatan listrik. Alat yang digunakan oleh Coulomb menyerupai alat yang digunakan Cavendish untuk menyelidiki konstanta gravitasi, dinamakan timbangan torsi. Coulomb menyelidiki gaya listrik karenanya Ia menggunakan dua bola logam bermuatan listrik sedangkan Cavendish menyelidiki gaya gravitasi karenanya Ia menggunakan dua bola bermassa yang tidak bermuatan listrik.
Cara kerja timbangan torsi
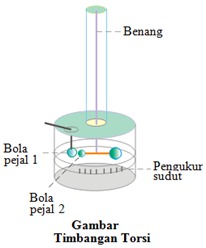 Cara kerja timbangan torsi berkaitan dengan pokok bahasan torsi atau momen gaya pada bab dinamika rotasi.
Cara kerja timbangan torsi berkaitan dengan pokok bahasan torsi atau momen gaya pada bab dinamika rotasi.
Ruang dalam timbangan torsi hampa udara untuk menghindari muatan listrik pada bola pejal berpindah ke udara. Penentuan jumlah muatan listrik pada bola pejal dilakukan menggunakan cara berikut. Pada mulanya bola pejal A dijadikan bermuatan listrik melalui konduksi atau gesekan. Bola pejal A yang telah bermuatan listrik dihubungkan dengan bola pejal B yang masih netral menggunakan konduktor listrik hingga muatan listrik bola pejal A terbagi merata dengan bola pejal B. Jika jumlah muatan listrik bola pejal A adalah ½ maka jumlah muatan listrik bola pejal B adalah ½ . Selanjutnya bola pejal B dan bola pejal C dihubungkan dengan konduktor listrik hingga muatan listrik bola pejal B terbagi merata dengan bola pejal C. Jika jumlah muatan listrik bola pejal B adalah ¼ maka jumlah muatan listrik bola pejal C adalah ¼ . Jumlah muatan listrik dan jenis muatan listrik yang dimiliki bola pejal 1 dan bola pejal 2 diperoleh dengan cara seperti ini.
Bola pejal 1 dan bola pejal 2 bermuatan listrik sehingga kedua bola pejal saling tolak menolak jika kedua bola bermuatan listrik sejenis atau saling tarik menarik bila kedua bola bermuatan listrik tak sejenis. Adanya gaya tarik atau gaya tolak antara kedua bola pejal bermuatan listrik menyebabkan bola pejal 2 berotasi. Sudut tempuh bola pejal 2 diukur untuk mengetahui gaya listrik yang bekerja pada kedua bola pejal.
Faktor-faktor yang mempengaruhi gaya listrik
Berdasarkan eksperimen yang dilakukan menggunakan timbangan torsi, Coulomb menemukan beberapa hal.
– Pada percobaan ini, jarak antara kedua bola pejal selalu sama. Ketika jumlah muatan listrik pada bola pejal 1 adalah 1 dan jumlah muatan listrik pada bola pejal 2 adalah 1 maka gaya listrik yang bekerja pada kedua bola pejal adalah 1. Ketika jumlah muatan listrik pada bola pejal 1 adalah 2 dan jumlah muatan listrik pada bola pejal 2 adalah 2 maka gaya listrik yang bekerja pada kedua bola pejal adalah 4. Coulomb menyimpulkan bahwa besar gaya listrik yang bekerja pada kedua bola pejal sebanding dengan hasil kali jumlah muatan kedua bola pejal (F ≈ q1 q2).
– Pada percobaan ini, jumlah muatan kedua bola pejal selalu sama. Jika jarak antara kedua bola pejal adalah 1 maka gaya listrik yang bekerja pada kedua bola pejal adalah 1. Bila jarak jarak antara kedua bola pejal adalah 2 maka gaya listrik yang bekerja pada kedua bola pejal adalah ¼. Coulomb menyimpulkan bahwa besar gaya listrik yang bekerja pada kedua bola pejal berbanding terbalik dengan kuadrat jarak (F ≈ 1 / r2)
Hukum Coulomb
Hukum Coulomb adalah salah satu hukum fisika yang menjelaskan hubungan antara gaya listrik, muatan listrik dan jarak antara muatan listrik. Hukum ini dirumuskan berdasarkan eksperimen yang dilakukan Coulomb sebagaimana telah dijelaskan pada tulisan sebelumnya.
Hukum Coulomb menyatakan bahwa besar gaya yang dikerjakan oleh suatu partikel bermuatan listrik pada partikel bermuatan listrik lainnya berbanding lurus dengan hasil kali jumlah muatan kedua partikel dan berbanding terbalik dengan kuadrat jarak antara kedua partikel bermuatan listrik. Gaya ini bekerja sepanjang garis lurus yang menghubungkan kedua partikel. Gaya listrik bersifat tolak menolak jika muatan listrik kedua partikel sejenis dan gaya listrik bersifat tarik menarik jika muatan listrik kedua partikel tak sejenis.
Hukum Coulumb dapat dinyatakan dalam persamaan matematis :
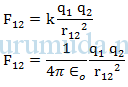 Keterangan rumus :
Keterangan rumus :
F12 = gaya listrik antara partikel 1 dan partikel 2
q1 = jumlah muatan partikel 1
q2 = jumlah muatan listrik partikel 2
r12 = jarak antara partikel 1 dan partikel 2
(baca : epsilon nol) = 8,854 x 10-12 C2/N.m2
k = (konstanta Coulomb) = 9 x 109 N.m2/C2
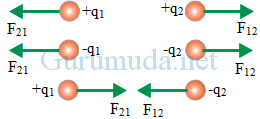 F21 adalah gaya yang dikerjakan muatan q2 pada muatan q1, sedangkan F12 adalah gaya yang dikerjakan muatan q1 pada muatan q2. F21 dan F12 saling tolak menolak ketika muatan q1 dan q2 sejenis dan saling tarik menarik ketika muatan q1 dan q2 tak sejenis.
F21 adalah gaya yang dikerjakan muatan q2 pada muatan q1, sedangkan F12 adalah gaya yang dikerjakan muatan q1 pada muatan q2. F21 dan F12 saling tolak menolak ketika muatan q1 dan q2 sejenis dan saling tarik menarik ketika muatan q1 dan q2 tak sejenis.
F21 dan F12 mempunyai nilai yang sama, berlawanan arah dan bekerja pada benda yang berbeda, karenanya kedua gaya ini merupakan pasangan gaya aksi reaksi.
(Ukuran kertas : F4, Jumlah halaman : 36)
Materi Pembelajaran :
- Muatan Listrik
- Hukum Coulomb
- Medan Listrik
- Fluks Listrik
- Hukum Gauss
- Energi Potensial Listrik
- Potensial Listrik
- Kapasitor

0 Response to "√Hukum Boyle, Hukum Charles Dan Hukum Gay?Lussac ⊗ Full Pembahasanya"
Posting Komentar